Bir fincan sıcak çayı masanın üzerinde bırakırsanız veya herhangi bir nesneyi daha serin bir ortamda bırakırsanız, kaçınılmaz olarak soğuyacağını herkes bilir. Ancak bunun tam olarak nasıl gerçekleşeceğini bize ancak termodinamik söyleyecektir. Günümüzde termodinamik dendiği vakit akla hemen ikinci yasası ve entropi kavramı gelir. Ancak temelinde bilinmesi gereken bundan çok daha fazlasıdır.
Termodinamik ısı, iş, sıcaklık ve enerji arasındaki ilişki ile ilgilenen bilim dalıdır. Basit bir ifadeyle enerjinin bir yerden başka bir yere ve bir biçimden başka bir biçime transferi ile ilgilenir. Yunanca thermos (ısı) ve dynamic (enerji) terimlerinden gelir.
Termodinamik ile kavramlar çoğunlukla 19. yüzyılda geliştirildi. Bu arayışının arka planındaki güç ise buhar makinelerinin yükselişiyle ilişki idi. Ama termodinamiğin yasaları formüle edilip, sonuçları keşfedildikçe, konunun ısı motorlarının, ısı pompalarının, soğutucuların veriminden tutun da, kimyadan yola çıkıp yaşam süreçlerine varana kadar, oldukça geniş olay aralığına dokunabileceği anlaşılacaktı.
Termodinamik Yasaları Nelerdir?
Termodinamiğin toplamda dört yasası var. Dördü de ısı ve enerjinin nasıl yer değiştirebileceğiyle ilgilidir. Numaralandırma garip bir biçimde sıfırdan başlar, üçte sonlanır. İlk iki yasa yani sıfırıncı ve birinci yasa sıcaklık ve enerjiyi anlatır. Bir sonraki yasa da karşımıza entropi kavramı çıkar. Son yasa ise daha teknik sorunlara ilgilidir.
Termodinamiğin Sıfırıncı Yasası
Termodinamikte, sistem kelimesini sık duyarsınız. Sistem bir demir blok, bir bardak su, bir motor, bir insan vücudu olabilir. Hatta sistem, bu varlıkların her birinin sınırlı bir parçası da olur. Sistemin ger kalanı da çevre olarak adlandırılmaktadır. Çevre, sistem üzerinde gözlem yapmak için bulunduğumuz ve onun özelliklerini çıkarsadığımız yerdir.
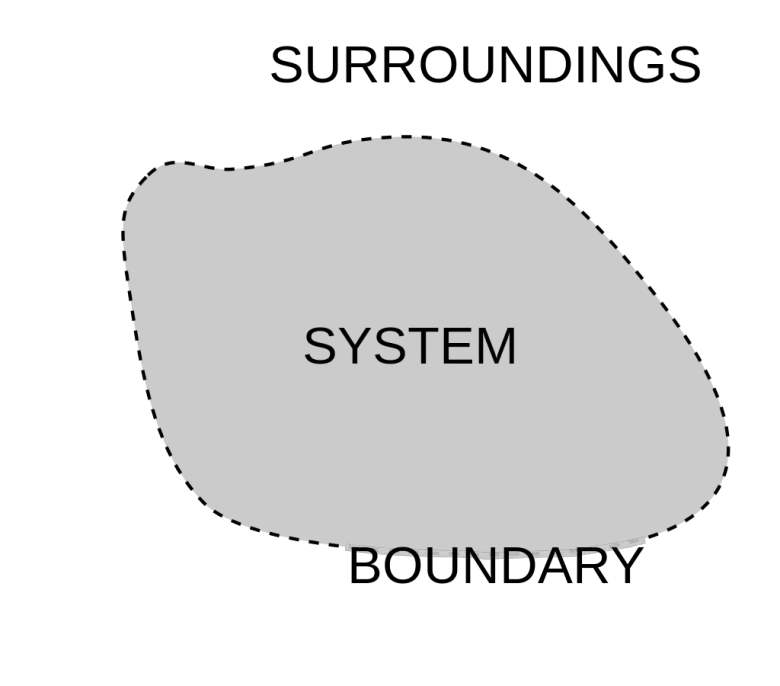
Bir sistem sınırıyla tanımlanır. Sisteme madde eklenebiliyor veya sistemden madde çıkartılabiliyorsa sistemin açık olduğu söylenir. Madde geçirgenliği olmayan bir sınırla çevreli bir sistem kapalı sistem olarak adlandırılacaktır.
Sıfırıncı yasa sonradan akla gelen bir düşüncedir. Böyle bir yasanın var olduğu uzun süredir biliniyordu. Buna rağmen yirminci yüzyılın ilk zamanlarına kadar yasaya bir isim verilmemişti. O zamana kadar birinci ve ikinci yasa iyice kökleşmiş olduğu için geriye dönmenin ve onları yeniden numaralandırma olanağı da yoktu.
Bunun sonucunda da 1931 yılında Ralph H. Fowler tarafından tanımlanan bu yasa “sıfırıncı yasa” adını almıştır. Termodinamiğin bu en basit yasasına göre eğer iki sistem, birbiriyle etkileşim içerisindeyken aralarında ısı veya madde alışverişi olmuyorsa bu sistemler, termodinamik dengededir.
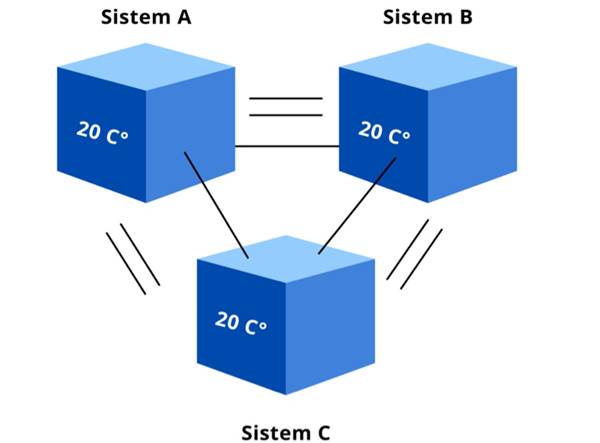
Sıfırıncı yasa sistemlerin bir araya getirildiklerinde ne zaman mekanik dengede olacağını tahmin etmemizi mümkün kılan bir fiziksel özellik olduğunu belirtir. Ayrıca iki sistemin ne zaman termal dengede olacağını tahmin etmemizi mümkün kılan bir özelliğinde var olduğunu söyler. Bu evrensel özelliğe sıcaklık deriz. Sıfırıncı yasa, sıcaklık ölçen alet olan termometrenin varlığının temelidir.
Tipik bir termometre, civanın sıcaklığa bağlı genleşmesinden veya maddenin elektriksel özelliklerdeki değişiminden yararlanır. Bu nedenle, bir B sistemini A’yla termal temasa geçirip, termometrenin değişmediğini gözlüyorsak, daha sonra termometreyi C’yle temasa geçirip hala değişmediğini gözlersek, o halde A ve C’nin aynı sıcaklıklara sahip olduğunu söyleyebiliriz.
Termodinamiğin Birinci Yasası
Termodinamiğin Birinci Yasası bilindik bir gerçeği ifade eder. Enerji bir türden başka bir türe dönüştürülebilir fakat yaratılamaz veya yok edilemez. Genelde biraz daha teknik bir dille ifade edilmektedir. Bir sistemin iç enerjisindeki değişim, sisteme dışarıdan verilen ısı eksi sistemin çevresi üzerinde yaptığı iş miktarına eşittir. Özü itibarıyla bu yasa “her şey iş yapmak için enerjiye ihtiyaç duyar” anlamına gelir.
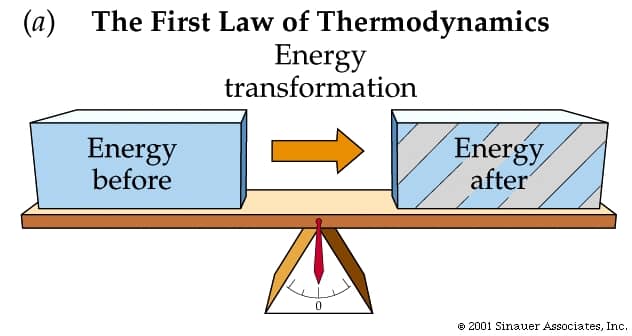
Birinci yasaya göre enerji vardan yok edilemez, yoktan var edilemez. Sadece bir biçimden diğerine dönüşür. (örneğin ısıdan elektriğe). Buna karşın dışarıdan (çevre) sisteme (ilgilendiğiniz şey) enerji eklenebilir. Enerji kendiliğinden ortaya çıkamaz. Eğer bir sistem ya da cisim enerji kazanırsa bu enerji mutlaka başka bir kaynaktan sağlanmak zorundadır.
Sıfırıncı ve birinci yasalar için gördüğümüz gibi bizi termodinamik bir özelliğini tanımaya yönlendirir. Sı fırıncı yasada sıcaklık ve birinci yasada enerji kavramını yeniden tanımlarız. Benzer şekilde, ikinci yasa da termodinamiğin bir başka özelliğinin varlığına işaret eder. Bu ise entropidir.
Evinizi tamamen düzelttikten kısa süre sonra yeniden dağınık hale geldiğini hiç fark ettiniz mi? Bu düzenden düzensizliğe geçme eğiliminin bir adı vardır ve buna entropi denir. Entropi bir sistemdeki düzensizliktir.

Termodinamiğin İkinci Yasası ve Entropi
Bu, yatak odanızın dağınıklığından, termodinamik ve bilgi teorisi gibi konulara ve Evrenin nihai kaderine kadar bağlama göre değişen tanımları olan bir kavramdır. En basit tanımıyla, yüksek derecede entropi, yüksek bir düzensizlik durumu ile ilişkilidir. Tersine, düşük entropi ise daha organize bir durum ve düşük düzeyde düzensizlik anlamına gelir. Tüm sistemler maksimum entropiye doğru evrilecektir.
Bir iskambil destesi renklerine ve sayılarına göre, ikiden asa kadar dizilmişse, böyle bir destenin entropisi düşüktür. Kartları karıştırdığımız zaman da, destenin entropisi artar. Kartlar tamamen karıştığında entropi artık en yüksek değerine ulaşmış demektir; daha çok karıştırmakla düzen daha fazla bozulamaz.
Kurmalı bir oyuncak kuruluyken entropisi düşüktür; yayı boşaldıkça entropisi artar. Tamamen boşaldığın da, kendimiz enerji harcayarak tekrar kurarız. Bu sayede entropisini tekrar eski düşük seviyesine getiririz. Termodinamiğin ikinci yasasına göre, dışarıdan enerji verilmediği sürece entropi hep artar, hiç azalmaz. Oyuncağın entropisi azalır fakat biz onu kurarak “iş yaparız”. Bunun sonucunda, bizim entropimizdeki artış miktarı, oyuncağın entropisindeki düşüş miktarını karşılar.
Termodinamiğin ikinci yasası, istatistiksel ilkeleri kullanarak çok sayıda nesnenin davranışını tanımlayan istatistiksel mekanik alanından gelir. Bunun yararlı olduğu bariz bir yer, gazların veya sıvıların davranışıdır.
Her sistemin bir makro durumu (şekli, boyutu, sıcaklığı vb.) ve birkaç mikro durumu vardır. Mikrodurumlar, o sistem içindeki tüm moleküllerin düzenini ve nasıl etkileştiklerini tanımlar. Her düzenlemenin (her bir mikro durumun) “olma” şansı vardır. Entropi, sistemin mevcut mikro durumunun ne kadar olası olduğunu ölçmenin bir yoludur.
Entropi çok karmaşık bir konudur. Sadece uygulandığı sistem aracılığıyla tanımlanabilir, bu nedenle farklı akademik alanlar bir şekilde bu kavramın belirli unsurlarına odaklanacaktır. Bunun sonucunda farklı tanımlamalara rastlamanız mümkündür. Entropinin matematiksel formülü aşağıda gördüğünüz gibi Ludwig Boltzmann’ın mezar taşında yer almaktadır.
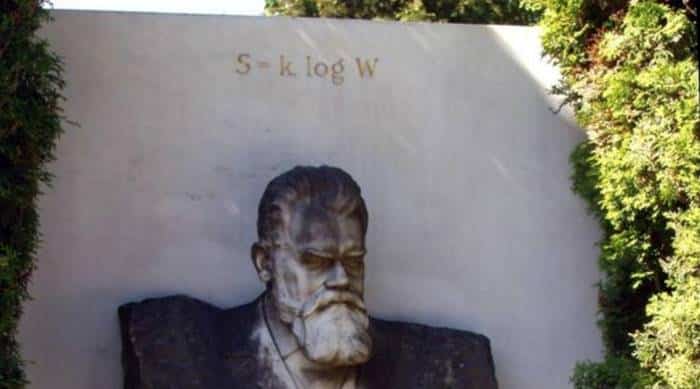
Entropiyi ifade eden geleneksel matematiksel sembol S’dir. Hem bu hem de adı, konu üzerine detaylı çalışmalar yapan Alman matematikçi ve fizikçi Rudolf Clausius’a (1822-1888) tarafından tanımlanmıştır. Entropide olan değişiklik ΔS biçiminde gösterilirse Termodinamiğin İkinci Yasasının kısa ve öz bir temsili şu şekilde olur: ΔS ≥ 0
Termodinamiğin Üçüncü Yasası
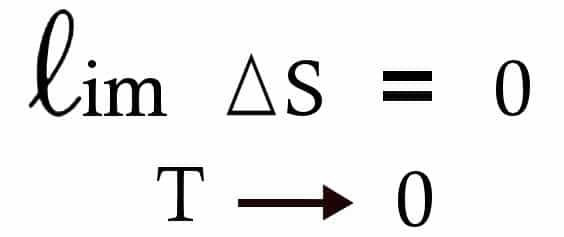
Termodinamiğin üçüncü yasası, bir sistemin özelliklerini ve entropinin mutlak sıfır olarak bilinen benzersiz bir ortamdaki davranışını tahmin eder. Mutlak sıfır, bilinen en düşük sıcaklıktır. Mutlak sıfır 0 Kelvin veya -273,15 santigrat derece olarak bilinmektedir.
Üçüncü yasa, bir sistemin sıcaklığı mutlak sıfıra yaklaştıkça entropisinin sabit hale geldiğini veya entropideki değişimin sıfır olduğunu belirtir. Üçüncü yasa, günlük yaşamlarımıza nadiren uygulanır. Bu yasa bizi bilinen en düşük sıcaklıklarda nesnelerin dinamiklerini yönetir.
Termodinamik, sıcaklık, ısı, iş ve enerjinin dahil olduğu her yerde bir rol oynar, bu nedenle hava tahmininde ve gezegenlerin, ayların ve hatta kara deliklerin evriminde rol oynadığını görmek o kadar da şaşırtıcı değildir.
Ancak hepsi bu kadar değil: Termodinamik aynı zamanda bilgiyi, zamanı ve hayatı anlamakla ilgili temel sorulara yaklaşmanın yeni yollarını da açmıştır. Bunlardan bir tanesi de zaman algımız ile ilgilidir. Yazının devamında göz atmak isterseniz: Termodinamik Yasaları Çerçevesinde Odanızı Neden Toplamamalısınız?
Kaynaklar ve İleri Okumalar:
- Maths in a minute: The second law of thermodynamics. Yayınlanma tarihi: 2 Haziran 2016; Bağlantı: https://plus.maths.org/
- Entropy and the Second Law of Thermodynamics: Disorder and the Unavailability of Energy; https://courses.lumenlearning.com
- What is entropy, and why is it always increasing? Yayınlanma tarihi: 2 Ocak 2021; Bağlantı: https://www.zmescience.com/
Matematiksel